作为“降糖+减肥”双领域备受关注的“顶流”靶点,GLP-1保持着市场热度。
在美国糖尿病协会第83届年会科学会议上,GLP-1领域的行业布局受到了广泛关注。跨国大药企如礼来、勃林格殷格翰等企业均公布了相关产品的最新研发进展。同时,国内创新药企如恒瑞医药、先为达、硕迪生物、银诺医药等也崭露头角,展现了良好的发展势头。
然而,在GLP-1药物频频传来喜讯之际,欧洲药品管理局(EMA)将GLP-1药物标记为甲状腺癌潜在风险的新闻引发了业内对于合理用药的审慎思考。市场观点认为,在巨大的需求下,本次EMA发出的提醒或许能给GLP-1过热的创新热潮“降降温”。
1。
GLP-1的研发进展令人欣喜。
全球各大企业纷纷前来。
礼来作为新星之中的耀眼者,本次也携带数个产品来到会议。首先,在小分子GLP-1R赛道上,Orforglipron已经进入三期临床阶段。在ADA会议上,公布了糖尿病和减重两项二期临床的数据,并且这两项二期临床数据也同时发表在柳叶刀和新英格兰期刊上。

在减重二期临床中,45mg剂量组治疗36周减重14.7%,相比安慰剂减重12.4%。糖尿病二期临床中,Orforglipron治疗26周Hb1Ac降低2.1%,减重10.1kg,安慰剂和度拉糖肽组分别降低0.43%和1.10%,减重分别为2.2kg和3.9kg。由此可见,口服小分子Orforglipron无论是降糖还是减重效果,都明显超过度拉糖肽。
礼来公司同时公布了其三靶点激动剂Retatrutide治疗肥胖、NAFLS、糖尿病的二期临床数据。该药物同时表示,已经启动了三期临床,并认为其有望在Tirzepatide的基础上进一步提高疗效。预计最高剂量可以减重22-24%,主要减少脂肪,降糖效果可以将Hb1Ac降低2%。
值得注意的是,信达生物和礼来合作开发的产品GLP-1R/GCGR双靶点激动剂Mazdutide的临床前数据也在会议上公布。该产品此前已经披露了II期临床数据,在糖尿病二期临床中,Mazdutide治疗20周后Hb1Ac降低了1.67%,安慰剂组为0.03%,度拉糖肽对照组为1.35%。在肥胖二期临床中,6mg剂量组Mazdutide治疗24周后体重相对安慰剂组减轻了12.62%。
勃林格殷格翰/Zealand在ADA会议上公布了GLP-1R/GCGR双靶点激动剂Survodutide治疗超重/肥胖患者的二期临床数据。患者在20周计量爬坡和26周维持治疗后,4.8mg剂量组治疗46周后减重19%,超过40%的患者减重超过20%。
CarmotTherapeutics公司展示了其核心管线——GLP-1R/GIPR双靶点激动剂CT-388。该产品刚刚完成了1.5亿美元的E轮融资,用于推进临床开发。此外,韩国D&D公司、印度太阳药业以及TernsPharmaceuticals公司等均公布了小分子GLP-1R激动剂的研究数据。
与此同时,国内多家创新药企也在展示肌肉。
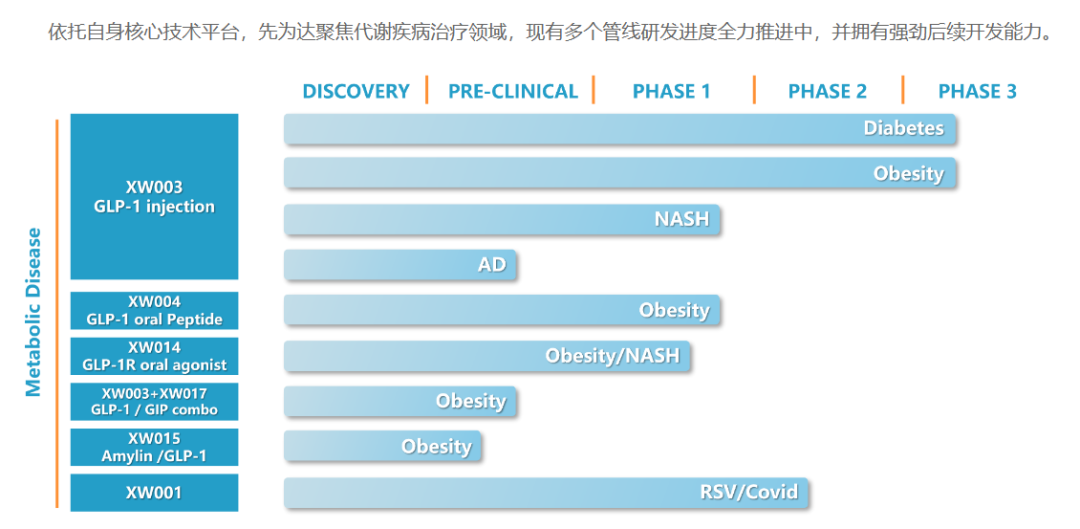
先为达研发的Ecnoglutide(XW003)是一款具有偏向性的新型长效GLP-1受体激动剂。它经过优化,提高了生物活性,降低了生产成本,并满足了每周给药一次的需求。在I期和II期临床研究中,Ecnoglutide表现出良好的安全性和耐受性,无论是2型糖尿病患者还是肥胖症患者都能从中获益。在本次ADA2023年会上,公布了三项最新数据。
在糖尿病2期临床研究中,Ecnoglutide(0.4mg、0.8mg、1.2mg)治疗20周后,Hb1Ac降低了1.81%-2.39%,而安慰剂组则降低了0.55%。在肥胖2期频次中,1.2mg、1.8mg、2.4mg治疗26周后,体重降低了11.5%、11.2%、14.7%,而利拉鲁肽3.0mg组则降低了8.8%。基于这些积极的临床研究结果,先为达公司于今年年初启动了Ecnoglutide中国III期注册临床试验的受试者招募,并已完成全部受试者入组。预计将于2024年获得顶线数据。
恒瑞医药最近公布了口服小分子GLP-1RA(HRS-7535)和GLP-1/GIP双受体激动剂(HRS9531)的临床I期数据。在HRS-7535的I期临床数据中,共有24例患者接受了SAD和MAD治疗,其中MAD治疗29天体重下降4.38kg。HRS9531SAD部分共有60例患者,其中30例接受MAD治疗;在MAD中,0.9-5.4mg组第29天时平均减重4.3-7.7kg,5.4mg剂量组治疗36天减重8.0kg。这些数据表明HRS-7535和HRS9531具有良好的安全性和疗效,因此可以支持进一步的临床开发。
除了恒瑞、先为达和信达等企业,银诺医药也公布了苏帕鲁肽单药治疗和联合二甲双胍治疗二型糖尿病的临床数据。此外,硕迪生物的小分子GLP-1R激动剂GSBR-1290的最新临床数据也已发布,并表示将于今年底获得该药糖尿病和肥胖2a期临床治疗12周的初步疗效数据。
2
GLP-1的合理用药警示。
「谨慎使用Off-label」。
6月22日,据媒体报道,欧盟药品管理局(EMA)将诺和诺德的Ozempic和Wegovy以及礼来的Mounjaro等GLP-1药物标记为甲状腺癌的潜在风险,要求相关企业在7月26日之前提交更多信息。

EMA对GLP-1类药物的安全性产生担忧,这要归因于去年发表的一项临床研究。2022年11月10日,《糖尿病护理》杂志上发表了一篇名为《GLP-1受体激动剂与甲状腺癌的风险》的研究。
研究人员对2006年至2018年期间接受二线治疗的2型糖尿病患者进行了研究。在排除有癌症病史的患者后,研究人员分析了2572名甲状腺癌患者和45184名未患甲状腺癌患者的数据。结果显示,与未使用GLP-1类药物的患者相比,使用GLP-1类药物1-3年或3年以上的患者患甲状腺癌的风险更高。
据悉,欧洲药品管理局(EMA)已加强对GLP-1治疗的审查,这是监管机构监测可能与已批准药物相关的潜在不良事件的第一步。“诺和诺德意识到EMA的信号和要求,并将对所有相关数据进行彻底评估,以阐明这一主题。”诺和诺德在一份声明中表示。受此消息影响,诺和诺德近日股市持续下跌。
实际上,在GLP-1中“网红明星”产品司美格鲁肽的临床前试验中,小鼠甲状腺C细胞肿瘤发病率增加。发表在《柳叶刀》上的一项研究表明,长期服用利拉鲁肽长达104周的大鼠和小鼠会以剂量依赖性方式导致甲状腺C细胞增生和C细胞肿瘤形成。因此,美国FDA已经对这种药物进行了“黑框警告”,警告使用者患甲状腺癌的风险。
然而,GLP-1受体激动剂已经用于治疗2型糖尿病超过15年。相关企业表示,在过去十几年的大型临床试验项目和上市后监测中,没有发现司美格鲁肽或利拉鲁肽与甲状腺癌的发生存在因果关系。
这表明,关于GLP-1与甲状腺癌之间的纠纷已经持续了很长时间,目前还没有确凿证据能够证明二者之间的关联。对于正在研发的相关企业来说,这是一个“无足轻重”的问题,他们需要集中精力研发更有效的产品。
对于诺和诺德公司来说,股市的波动只是暂时的。事实上,早在2021年,司美格鲁肽获得批准用于减重适应症时,就已经存在黑框警告。然而,这并未影响该药物的销量。2022年,该药物的收入达到了109亿美元,同比增长了78%。这充分证明了其“药王”的资质。
与此同时,由于减肥市场需求旺盛,FDA已发文警告一些药店涉嫌制造未经授权的诺和诺德糖尿病和肥胖药物。为此,诺和诺德已对美国的五家药店提起诉讼。

诺和诺德宣布,已对美国一些医疗水疗中心、减肥或健康诊所以及复合药房提起法律诉讼,旨在停止这些机构的虚假广告、商标侵权和/或非法销售声称含有semaglutide的非FDA批准的复合产品Ozempic和Wegovy。该公司表示:“这些非法的营销和销售行为,包括在这些行为中使用诺和诺德商标,已经创造了高风险的消费者混淆和欺骗以及潜在的安全问题。”
毫无疑问,GLP-1是近年全球医药市场竞争中备受瞩目的靶点之一。市场观点认为,由于其作用机制多样且具有长效性、多种药物形式、多靶点和多适应症等迭代和差异化的研发潜力,GLP-1在相关研发领域仍然具有很大的潜力。然而,在企业竞争、营销推广、产品安全和风险警告等方面,也给合理用药带来了压力,特别是在Off-label使用时应当谨慎。
编审:朱狄
欢迎访问我们的网站:www.yyjjb.com.cn
把握行业趋势
长按,关注医药经济报。
长按关注免疫时间 《医药经济报》
学术性微信公众号
关注肿瘤学术前沿。
长按关注,获取免疫时间。
长按关注免疫时间 《医药经济报》
终端公众号,记录药品终端产经大事件。
记录药品终端产业的重大事件。
长按关注,21世纪药店。