
心血管疾病的风险仍然存在
CVD是我国人群死亡的首要原因,其患病率正在持续上升。2021年,CVD死亡人数达到了400万例,占总死亡人数的40%以上。高脂血症是CVD最重要的危险因素之一,尽管近年来降脂新药不断涌现,但他汀、依折麦布以及PCSK9抑制剂仍然是三大最重要的“武器库”。 在一项包含49项RCT研究的荟萃分析中,LDL-C每下降1mmol/L,主要血管事件风险降低23%(RR:0.77[95%CI0.75-0.79];P<0.001)。IMPROVE-IT试验、FOURIER试验以及ODYSSEYOutcomes试验也证实,即使在接受他汀类药物治疗后,仍有65%~75%的心血管事件残余风险。而他汀联合依折麦布或PCSK9抑制剂,则分别能进一步降低6%和15%的风险。
图1显示了降脂药物对心血管事件风险的降低。
肥胖和糖尿病患病率的增加是导致心血管事件风险居高不下的重要因素。自2000年以来,人们对甘油三酯(TG)水平等指标的关注日益增加。TG、富含甘油三酯的脂蛋白(TRL,包括乳糜微粒和VLDL)以及TRL残余物水平的增高都会导致ASCVD风险增加。具体来说,每升高1mmol/L的TRL,CVD风险将增加2.8倍。因此,TRL及其残余物也是导致心血管残余风险的主要因素。
关于TRLs的组成、作用和代谢方式。
TRLs指的是富含甘油三酯的脂蛋白,而TRL残留物则是指TRL被脂解后产生的富含胆固醇酯(CE)的脂蛋白,包括乳糜微粒残留物和VLDL残留物。当巨噬细胞吞噬TRL残留物时,会形成泡沫细胞,这有助于动脉粥样硬化斑块的发生和发展。由于富含胆固醇的残余颗粒携带更大的胆固醇负荷,因此它们不需要经过氧化修饰即可被巨噬细胞吸收,比低密度脂蛋白(LDL)更有效地诱导形成泡沫细胞。因此,降低血浆甘油三酯,减少TRL和TRL残留物的生成,有助于减少心血管事件。
早年有观点认为,肥胖患者接受冷刺激将促进脂肪分解产热对抗寒冷。然而,相关实验室结果显示,冷刺激将促进AS斑块的生长和不稳定。接受冷刺激时间越长,斑块生长越快(图2)。因此,寒冷导致心血管事件的新机制进入了大众视野。 寒冷刺激可诱导交感神经β3受体兴奋,导致环磷腺苷(cAMP)升高,解偶联蛋白-1(UCP-1)表达增加。脂解形成游离脂肪酸与甘油入肝脏形成VLDL与LDL,从而促进斑块生长以及心血管事件的发生(图3)。 进一步探索β3受体激动剂的作用还发现,β3受体激动剂米拉贝隆会加重ApoE-/-小鼠AS病变。这证实了β3受体是寒冷的下游,而米拉贝隆也能够促进脂降解、加重AS病变。 此外,在脂肪组织特异敲除HuR的脂质代谢正常的小鼠中,可观察到甘油三酯升高、白色脂肪增多,HDL降低,LDL升高,白色脂肪无法转化为棕色脂肪。这表明HuR对脂肪组织和肥胖同样存在作用机制。
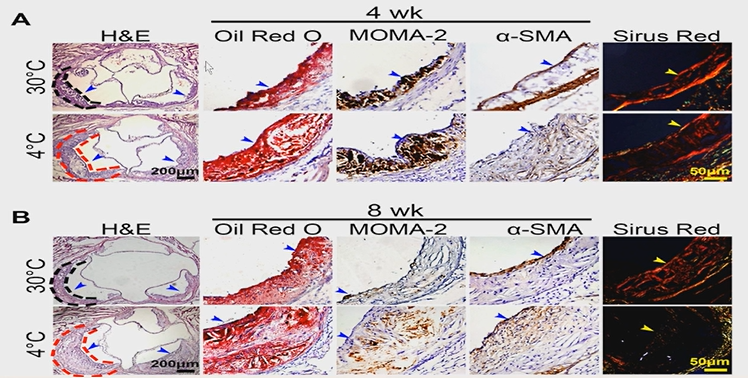
图2.冷刺激可促进AS斑块的生长和不稳定。
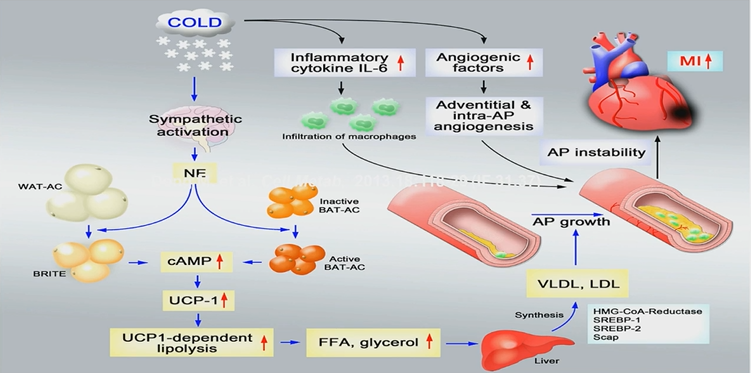
图3.寒冷诱发心血管事件的新机制。
TRLs分为乳糜微粒(CM)和VLDL两种。CM是在小肠中合成的,当脂肪食物被消化后,小肠黏膜细胞会合成TG。TG与apoB48、apoC、apoAI、apoAIV、磷脂和胆固醇等组装成CM,然后被肠粘膜细胞分泌,通过淋巴系统进入血液循环。而VLDL则是在肝脏中合成的。干细胞会合成甘油三酯,并与apoB100、apoC、apoE、磷脂和胆固醇等组装成VLDL,然后分泌入血。 TRLs的脂解反应(图4)受到脂蛋白脂肪酶(LPL)的影响。LPL在脂肪组织、骨骼肌和心脏中合成后,会转移到毛细血管。LPL与毛细血管内皮细胞表面的GPIHBP1结合,分解TRLs,释放游离脂肪酸、乳糜微粒残留物和中密度脂蛋白(IDL),即TRL残留物。 TRLs的脂解也受到ApoC2、ApoC3、ANGPTL4、ANGPTL3/ANGPTL8和ApoA5等因素的调控(图5)。
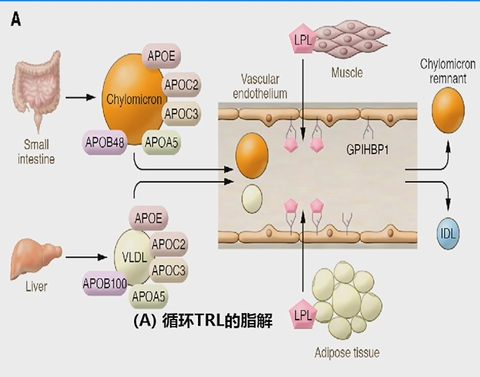
图4.脂解反应过程
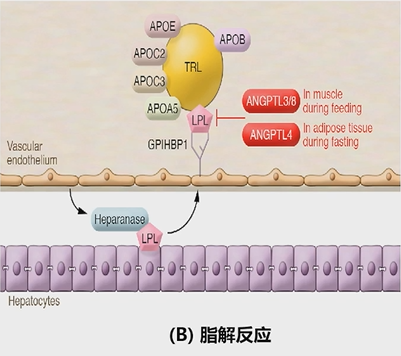
图5.脂解反应过程
鱼油的降脂作用及其分子机制。
多不饱和脂肪酸(PUFA)是指含有2个或2个以上不饱和键的脂肪酸。通常来说,PUFA由12-24个碳原子组成,并且有α端(羧酸端)和N端(甲基端)之分。从脂肪酸碳链N端算起,第一个双键出现在第3位碳原子的PUFA被称为n-3PUFA(Omega-3)。n-3PUFA主要来源于鱼油,而少量则来自于植物油中的亚麻酸(ALA),其中富含二十碳五烯酸(EPA,C20:5n-3)和二十二碳六烯酸(DHA,C22:6n-3)。鱼油的主要功效成分是DHA和EPA,它们能够调节血脂等。而鱼肝油的主要功效成分是维生素A和维生素D,它们的作用与鱼油不同。
鱼油衍生药物(二十碳五烯酸乙酯)是一种处方类ω-3药物,其主要成分超纯度EPA含量超过96%。该药能降低肝脏中VLDL和TG的合成和分泌,并增强循环VLDL颗粒对TG的清除率。其作用机制包括增加β-氧化、抑制1,2-二酰基甘油酰基转移酶(DGAT)、减少肝脏脂肪生成以及提高血浆LPL活性等。
在2018年,AHA大会上公布了一项重磅研究结果,即高纯度鱼油RUDUCE-IT研究(图6)。该研究共纳入8179例高风险患者,其中76%为黑人,他们已经接受了他汀类药物治疗,并且LDL-C水平控制良好(1.06-2.59mmol/L),但TG水平升高(1.69-5.63mmol/L)。这些患者被随机分配接受EPA2gbid或含矿物油的安慰剂治疗,中位随访4.9年。主要终点包括心血管死亡、心梗、卒中、冠脉血运重建和不稳定性心绞痛。研究结果显示,ApoB下降了9.7%,TG仅下降了2%。基于REDUCE-IT研究提供的数据,FDA于2019年12月扩大了IPE适应证,作为已达到他汀类药物最大耐受剂量的附加治疗,以帮助甘油三酯水平≥150mg/dL且确诊患有心血管疾病或糖尿病合并两个或多个其他心血管疾病危险因素的成年患者降低心脏病发作、卒中、冠脉血运重建和不稳定性心绞痛需要住院的风险。他汀与高纯度鱼油的强强联合也是目前降脂治疗的新途径。
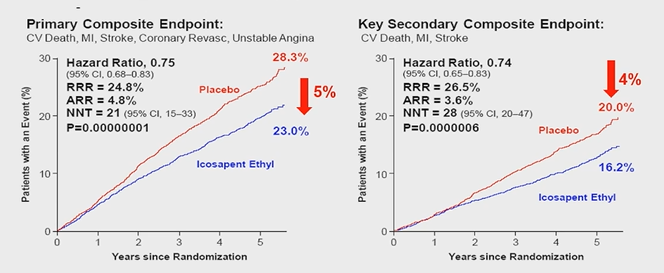
图6.REDUCE-IT研究结果。
在2021年,REDUCE-ITPRIORMI亚组分析结果(图7)公布。该研究纳入了REDUCE-IT试验中既往心肌梗死病史的患者,其中IPE组1870例,安慰剂组1823例。中位随访4.9年,结果显示IPE4g/d使既往心肌梗死患者的首次和总体(首次+再发)主要终点发生风险分别显著降低26%和35%(P均<0.001),次要终点风险显著降低32%(P<0.001)。这表明心梗患者获益更大。
图7显示了REDUCE-ITPRIORMI亚组分析结果。
然而,在另一项STRENGTH研究中,Omega-3CA并未对心血管健康产生有益影响,这一结果再次引发了临床讨论。该研究纳入了13708例高心血管风险和致AS血脂异常患者,随机分为接受4g/dOmega-3CA的治疗组(n=6539)以及玉米油对照组(n=6539),中位随访时间42个月。结果显示,ApoB并未明显下降。近年来,另外数项关于混合Omega-3脂肪酸(EPA+DHA)的临床试验STRENGTH、VITAL、ASCEND试验也均未显示出相关的心血管获益,提示只有高纯度鱼油才具备获益机制。
总的来说,REDUCE-IT研究中甘油三酯水平仅降低了2%,但临床不良心血管事件风险降低了25%。目前尚不清楚降低心血管事件的机制,但REDUCE-IT试验预先制定的血清EPA分析结果显示,纯鱼油制剂治疗后,患者的EPA水平升高了近4倍,DHA水平下降了2.9%(P=0.0015)。EPA水平较高的人群存在多种临床获益:治疗时,EPA水平较高的患者中,主要终点、主要次要终点、心血管死亡、全因死亡率均显著降低;致死性和非致死性心肌梗死、中风、冠脉血运重建、不稳定性心绞痛等住院风险降低也与EPA水平有强烈关联;心源性猝死、心脏骤停与治疗时的EPA水平显著相关,较高的EPA可能与心衰风险降低有关;AHA2022上公布的RESPECT-EPA试验评价了他汀类药物和EPA联合治疗用于心血管疾病二级预防效果的随机试验,同样取得了显著获益。
除了鱼油的作用,鱼油分子的机制探索也取得了重要的进展。今年,在Science上首次揭示了鱼油受体GPR120识别脂肪酸的分子机制(图8、9)。研究团队发现EPA可以通过特殊通道仅与亚型OA-GPR120相结合,从而起到相应的疗效。未来,团队也将进一步针对EPA抗动脉粥样硬化的机制展开深入分析。
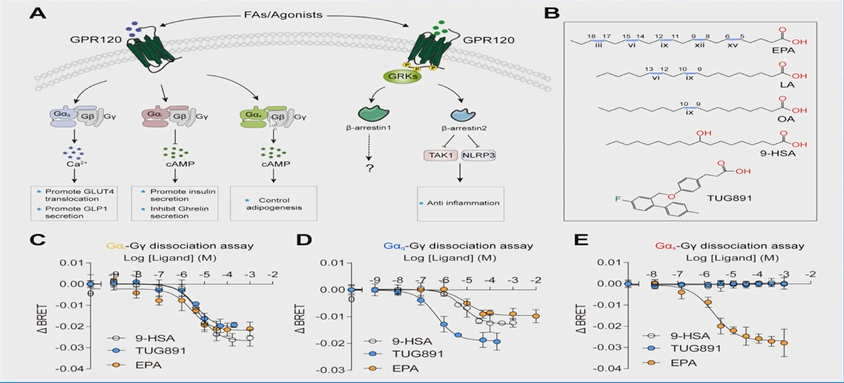
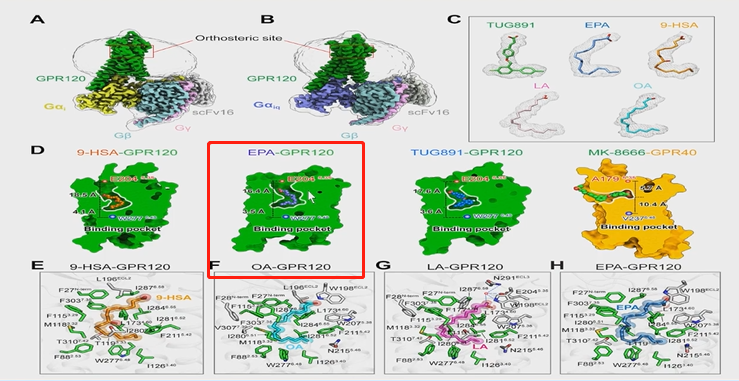
图8和图9展示了鱼油受体GPR120识别脂肪酸的分子机制。
PROMINENT试验的设计和结果。
Pemafibrate(培马贝特)是一种高效的过氧化物酶体增殖激活受体α(PPARα)激动剂,它能够诱导脂蛋白酯酶(LPL)表达,从而降低血浆TG水平并增加HDL水平。该药物于2017年正式上市,并被日本批准用于治疗高脂血症。根据以往贝特类药物试验的事后亚组分析,2型糖尿病、轻-中度高TG血症和低HDL-C血症患者能够显著获益。但是,目前尚不确定TG水平降低和HDL水平升高是否能够降低心血管事件的风险。
在2022年,AHA大会上公布了多国、双盲、随机、安慰剂对照试验PROMINENT的研究结果,该研究旨在探究培马贝特是否能通过降低糖尿病患者的甘油三酯水平来减少心血管事件。该研究纳入了10497例2型糖尿病患者,他们患有200-499mg/dL的TG,且HDL-C<40mg/dL,并且正在接受中或高强度的他汀类药物治疗。患者被随机分为安慰剂和培马贝特(2mgbid)两组,其中1/3为一级预防(无CVD),2/3为二级预防(确诊ASCVD)(图10)。入组标准为2型糖尿病,且200mg/dl≤空腹TG<500mg/dl,HDL-C水平≤40mg/dl,无ASCVD的≥50岁男性和≥55岁女性(一级预防队列)或已患有ASCVD的≥18岁以上人群(二级预防队列);排除标准为1型糖尿病、未控制的糖尿病、未经治疗或治疗不充分的甲减或甲亢、严重心力衰竭、严重肾脏疾病、具有临床意义的肝病。 这样修改后,内容更加简洁明了,更容易阅读。希望对你有帮助。
图10.PROMINENT试验设计方案。
基线资料显示,本研究纳入了10497例2型糖尿病患者,其中10%患有TG轻至中度升高,70%患有HDL-C降低,20%患有LDL-C控制良好。患者的中位年龄为64岁,其中27.4%为女性。95.7%接受了他汀治疗,其中超过2/3接受了高强度他汀治疗。80.1%接受了ACEI或ARB治疗,9.3%接受了GLP-1类似物治疗,16.8%接受了SGLT2抑制剂治疗。患者的糖化血红蛋白中位数为7.3%。
4个月的研究结果显示,TG水平培马贝特组下降了31.1%,而安慰剂组下降了6.9%,两组之间的差异为26.2%。VLDL-C培马贝特组下降了35%,而安慰剂组下降了10.5%,两组之间的差异为25.8%。残余胆固醇(TC——HDL-C——LDL-C)和Apo-C3的中位百分比培马贝特组较安慰剂组下降幅度更大,两组之间无明显差异。TC和非HDL-C水平两组无明显差异,而HDL-C和LDL-C水平培马贝特组高于安慰剂组。在主要和次要终点事件方面,培马贝特组与安慰剂组间无明显差异。在不良事件方面,两组之间无显著差异,但培马贝特组的非酒精性脂肪肝发生率低于安慰剂组(P=0.04),而在肾脏不良事件、静脉血栓栓塞、肺栓塞和深静脉栓塞的发生率中培马贝特组反而更高。
培马贝特能够减少TRLs,但也会导致血浆LDL-C和ApoB水平升高,而非HDL-C水平保持不变。这是由于培马贝特增加了LPL的活性,提高了残留脂蛋白转化为LDL的效率,同时降低了残留胆固醇水平所致。然而,血浆LDL-C和ApoB水平的升高也导致了HDL-C水平的升高,从而抵消了TG水平降低所带来的益处。在REDUCE-IT试验中,IPE组ApoB水平较安慰剂组降低了9.7%,从而降低了主要终点事件的发生率(HR:0.75,P<0.001);而在STRENGTH试验中,高剂量Omega-3CA未能降低ApoB水平,因此没有心血管获益。因此,在降脂治疗中,净降低致AS脂蛋白水平至关重要,而非单纯降低甘油三酯本身。
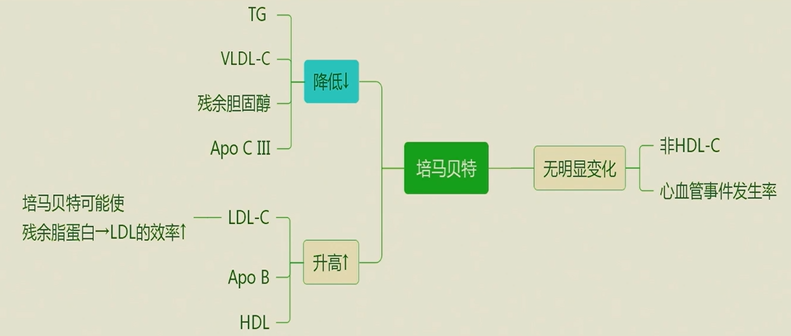
图11.培马贝特未能降低主要终点事件的原因可能是:
编辑:总结
在当前肥胖和糖尿病发病率上升的大背景下,高甘油三酯是我国常见的血脂异常类型。除了低密度脂蛋白胆固醇外,甘油三酯升高也会增加心血管风险。降低血浆甘油三酯,减少脂质过氧化物和残留物,可能有助于减少心血管事件的发生。但仍需要进一步验证。在降脂治疗中,关键是实现致动脉粥样硬化性脂蛋白水平的净降低。此外,促进脂解可能并非有益,抑制甘油三酯和超低密度脂蛋白的合成可能更为重要。未来,可以进一步探索同时降低甘油三酯和载脂蛋白B水平的新药。